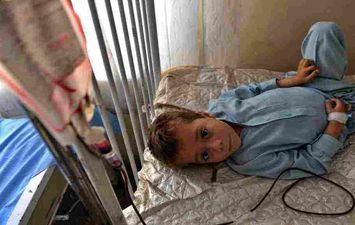
تقدّم الأساليب البديلة لزرع النخاع العظمي، والمتمثلة بالأدوية الجديدة وتجارب العلاج الجيني الناجحة، الأمل بإحداث التغيير المنشود في حياة مرضى الثلاسيميا، عبر المساعدة في إيقاف عمليات نقل الدم، التي يعتمدون عليها أو التقليل منها بشكل كبير، وفقا للدكتور ربيع حنا المختص في أمراض الدم وأورام الأطفال بمستشفى كليفلاند كلينك للأطفال.
ويُعدّ الثلاسيميا الاضطراب أحادي الجين الأكثر شيوعا في العالم، ويصيب كثيرا من الأشخاص من الشرق الأوسط ودول البحر الأبيض المتوسط وشمال إفريقيا والهند وآسيا الوسطى وجنوب شرق آسيا.
ألفا وبيتا
هناك نوعان للمرض، "ألفا" و"بيتا"، يُصنف بينهما المرضى اعتمادا على العيوب الجينية، التي يمكن أن تحدث في سلاسل البروتين، التي يتكون منها الهيموغلوبين.
ويميل مرضى الثلاسيميا ألفا إلى أن يكونوا حاملين صامتين من دون أعراض، في حين أن مرضى "بيتا" تظهر لديهم أعراض رئيسية في وقت مبكر بعد الولادة ويحتاجون إلى عمليات نقل دم متكررة، ما قد يؤدي إلى زيادة الحديد في الجسم واحتمال إصابة الكبد والقلب ونظام الغدد الصماء بالتلف.
العلاج الجيني
وقال الدكتور ربيع حنا إن ثمّة تطورات كبيرة حدثت في الأبحاث، التي تدور حول علاج الثلاسيميا في السنوات القليلة الماضية، حتى بات يُنظر الآن إلى الثلاسيميا باعتباره مرضا قابلا للعلاج. وأوضح أن العلاج الجيني يُعدّ خطوة جديدة تستخدم الخلايا الجذعية المكونة للدم لدى المريض لإنتاج خلايا دم حمراء أكثر صحة وعلاج اضطراب الدم الحاصل لديه.
وأشار إلى أن العلاج الجيني يظلّ أكثر شيوعا في البيئات البحثية من الممارسات السريرية، لكنه لفت من ناحية أخرى إلى أن التجارب السريرية تظهر نتائج واعدة جدا. وأضاف: "مرضى الثلاسيميا، الذين تلقوا علاجا جينيا استغنوا عن عمليات نقل الدم اللازمة للتعامل مع حالتهم الصحية، أو قلّلوا هذه العمليات إلى حدّ بعيد. فقد أثبت العلاج الجيني قدرته على تجاوز التحدّيات، التي يواجهها مرضى الثلاسيميا وإعانتهم على تحقيق أهدافهم وأحلامهم".
وبينما يُنظر إلى العلاج الجيني باعتباره علاجا يُقدّم لمرة واحدة لمرضى الثلاسيميا، أوضح الدكتور حنا أنه يتضمّن العلاج الكيميائي للتخلّص من نخاع العظم القديم وخلق حيّز لخلايا جذعية جديدة ومعدلة، في عملية وصفها بالمعقدة. وقال: "قد يتطلب الأمر الدخول إلى المستشفى لأسابيع تتراوح بين أربعة وستة، حتى تبدأ الخلايا الجذعية الجديدة في إنتاج خلايا الدم البيضاء والصفائح الدموية وخلايا الدم الحمراء الصحية.
وأضاف: "نأمل في أن نتمكن في المستقبل من استهداف نخاع العظم بطريقة أكثر انتقائية عبر علاج كيميائي منخفض الشدة أو أدوية أخرى لتجنب السمية الحادّة والطويلة، التي تحدث نتيجة الجرعات العالية من العلاج الكيميائي".
دواء luspatercept-aamt
وتشتمل التطورات الحديثة الأخرى، التي غيّرت خيارات العلاج المتاحة لمرضى الثلاسيميا على دواء بالاسم العام luspatercept-aamt، يُعطى على شكل حقنة كل ثلاثة أسابيع. وكان هذا الدواء حصل على موافقة إدارة الغذاء والدواء الأمريكية في العام 2019 ويعمل عبر تعزيز نضج خلايا الدم الحمراء وتقليل الحاجة إلى عمليات نقل الدم بنسبة تصل إلى 50 في المئة لدى بعض المرضى.
ولا يُعد luspatercept-aamt علاجا في حد ذاته، لكن طبيب أمراض الدم وأورام الأطفال بمستشفى كليفلاند كلينك للأطفال أشار إلى إمكانية استخدامه لتعزيز النتائج في عمليات زرع نخاع العظم العلاجية، التي أصبحت متاحة على نطاق واسع في السنوات الأخيرة بفضل اتباع نهج جديد في زراعة النخاع. وأوضح حنا أن انخفاض عمليات نقل الدم يعني تمتّع المريض بصحة أفضل قبل إجراء الجراحة، وأن لديه عددا أقلّ من الأجسام المضادة، التي يمكن أن تهاجم نخاع العظم المزروع.
وانتهى الدكتور حنا إلى القول: "سوف يصبح بالإمكان علاج أي مريض تقريبا، بفضل التوسع المرتقب في آفاق العلاج الجيني واستخدام الدواء luspatercept-aamt، اللذين سيسفران عن تحسين نتائج زراعة نخاع العظم".
ويوجد في جميع أنحاء العالم 270 مليون شخص حامل للمرض يشتمل دمهم على هيموغلوبين غير طبيعي وثلاسيميا، ويولد ما بين 300 ألف و400 ألف طفل مصابين باضطرابات خطرة في الهيموغلوبين سنويا، وفقا للمعهد الوطني الأمريكي للصحة.